お客様のご要望に沿って、医薬品原材料(原薬、包装材料、添加剤など)の海外向けMF登録をフルサポートいたします。
【このようなお悩みはございませんか?】
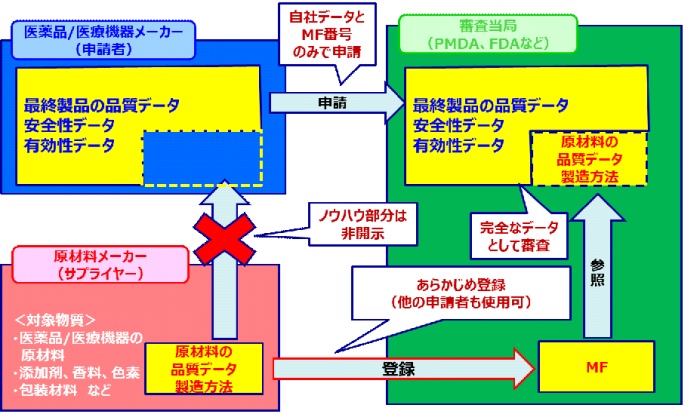
・医薬品メーカーから詳細情報の開示を求められたが、製造ノウハウは開示したくない。
・MF登録をしたいが、どんな情報を記載したらよいのかよくわからない。
・審査当局とのコミュニケーション(照会事項対応等)が不安。
・MF登録のため、各国で求められる試験(USPやEP、中国薬局方など)を実施したい。
米国
当社内専門家および米国の提携パートナーとの連携により、米国向けDMF(Drug Master File/ドラッグマスターファイル)の登録から管理まで一貫したサービスをご提供いたします。その際、必要となる情報・試験についてもコンサルティングいたします。eCTD形式での電子申請にも対応いたします。
<DMF登録できるもの>
・原薬、中間体及びそれらの製造に使用される原料(Type Ⅱ)
・包装材料(Type Ⅲ)
・添加剤、香料、色素など(Type Ⅳ)
● DMFの作成支援
● 新規DMFの登録申請代行(米国FDAへの提出)
● 米国薬事規制に関する情報提供、各種コンサルティング
● DMFの年次更新(Annual Reportの作成・提出)
● DMFの変更届(Amendment)の作成・提出
● LOA(Letter of Authorization/DMFの参照許可証)の作成支援
● FDAとのコミュニケーション支援(照会事項対応等)
● 製造所番号(Labeler Code)の申請手続き
● 製造所登録・年次更新手続き(Registration)
● 輸出品目及びラベルの登録・変更手続き(Listing)
● USP準拠試験など、DMF登録に必要なデータ取得をサポートいたします。
EU
当社内専門家およびEUの提携パートナーとの連携により、EU向けASMF(Active Substance Master File/原薬マスターファイル)の登録あるいはCEP(Certificate of Suitability to the monographs of the European Pharmacopoeia/ヨーロッパ薬局方適合認証)の認証取得から管理まで一貫したサービスをご提供いたします。その際、必要となる情報・試験についてもコンサルティングいたします。eCTD形式での電子申請にも対応いたします。
<ASMF登録できるもの>
・原薬のみ
<CEP登録できるもの>
・ヨーロッパ薬局方(EP)の各条に記載された医薬品製剤、原薬、添加剤など
● ASMFの作成支援
● 新規ASMFの登録申請代行(EMA(欧州医薬品庁)又は各国医薬品審査当局への提出)
● EU薬事規制に関する情報提供、各種コンサルティング
● ASMFの変更届(Amendmentの作成・提出)
● LOA(Letter of Access/ASMFの参照許可証)の作成・提出
● EMAとのコミュニケーション支援(照会事項対応等)
● CEPの作成支援
● 新規CEPの認証申請代行(European Directorate for the Quality of Medicine and Healthcare(医薬品品質管理理事会/EDQM)への提出)
● EDQMとのコミュニケーション支援(照会事項対応等)
● EU薬事規制に関する情報提供、各種コンサルティング
● CEPの変更届(Amendment)の作成・提出
● EMAとのコミュニケーション支援(照会事項対応等)
● EP準拠試験など、ASMF登録に必要なデータ取得をサポートいたします。
中国
当社内専門家および中国の提携パートナーとの連携により、中国向けDMF(Drug Master File/ドラッグマスターファイル)の登録から管理まで一貫したサービスをご提供いたします。その際、必要となる情報・試験についてもコンサルティングいたします。
<DMF登録できるもの>
・原薬、中間体及びそれらの製造に使用される原料
・包装材料
・添加剤、香料、色素など
● DMFの作成支援
● 新規DMFの登録申請代行(National Medical Products Administration(国家薬品監督管理局、NMPA)への提出)
● 中国薬事規制に関する情報提供、各種コンサルティング
● DMFの年次更新(年次報告書の作成・提出)
● DMFの変更届の作成・提出
● NMPAとのコミュニケーション支援(照会事項対応等)
● 中国薬局方あるいは添加剤・包装材料に係るYBB規定準拠試験など、DMF登録に必要なデータ取得をサポートいたします。NMPA認定施設でのデータ取得にも対応いたします。
技術事例
関連情報
